
Makalah Kelarutan Kelompok 3 MAKALAH KELARUTAN DAN HASIL KALI
Dokumen tersebut membahas tentang kelarutan dan hasil kali kelarutan, termasuk definisi, hubungan antara keduanya, dan pengaruh penambahan ion senama. Secara ringkas, dokumen menjelaskan bahwa kelarutan adalah jumlah maksimum zat yang dapat larut, sedangkan hasil kali kelarutan adalah hasil kali konsentrasi ion-ion dalam larutan jenuh. Hubungan antara keduanya ditentukan oleh stoikiometri reak

Kelarutan dan Hasil Kali Kelarutan YouTube
A. Karakteristik Materi Kelarutan dan Hasil Kali Kelarutan Materi kelarutan dan hasil kali kelarutan merupakan salah satu materi yang dipelajari di kelas XI semerter genap. Berdasarkan kurikulum 2013, kompetensi dasar dalam materi kelarutan dan hasil kali kelarutan ini antara lain : (1) memprediksi terbentuknya endapan dari suatu reaksi.

BAB 8 Kelarutan Dan Hasil Kali Kelarutan PDF
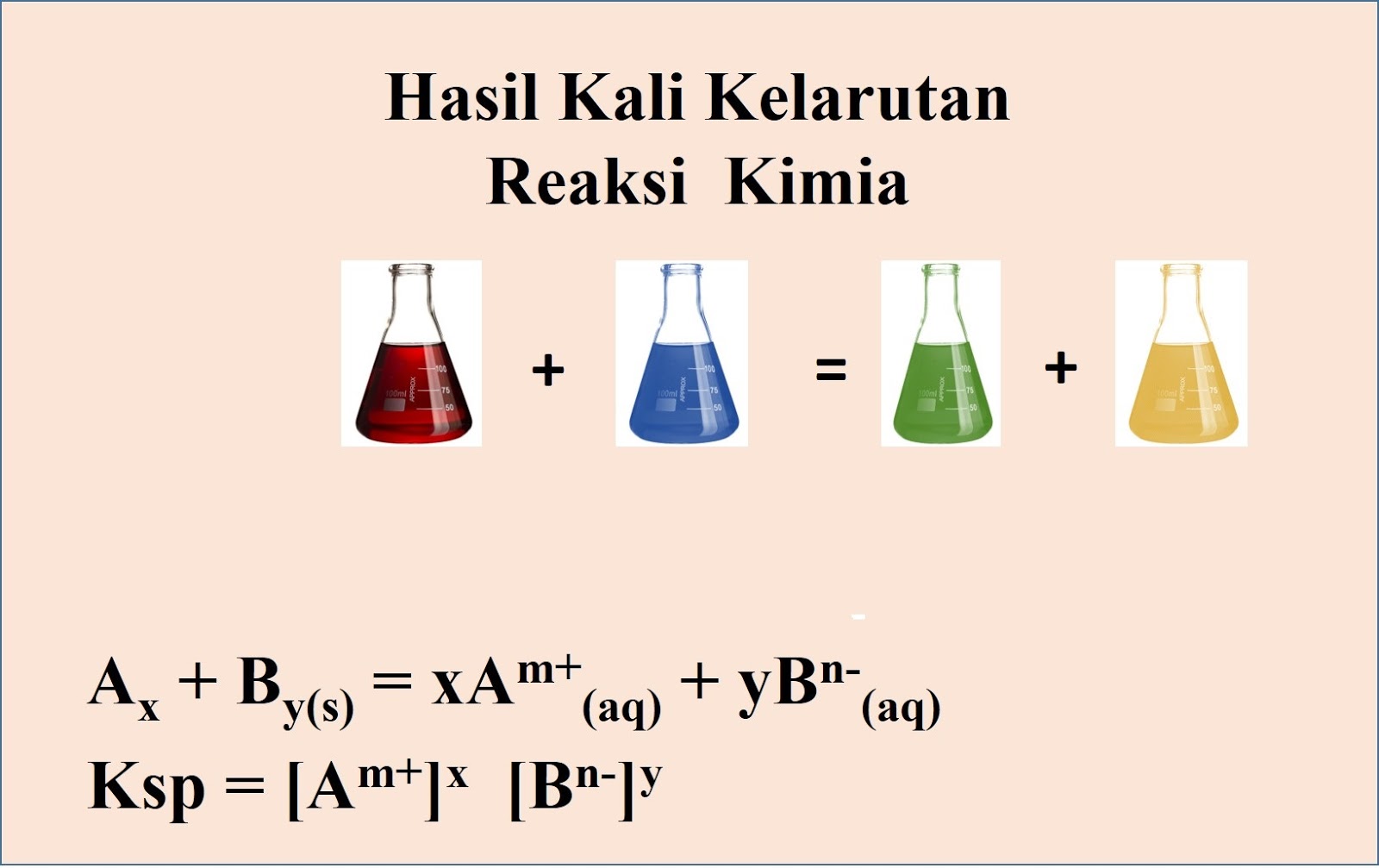
Hasil kali kelarutan (Ksp) dapat didefinisakan sebagai hasil kali konsentrasi ion-ion suatu elektrolit dalam larutan yang tepat jenuh. Secara umum, tetapan hasil kali kelarutan (Ksp) dapat dituliskan sebagai berikut: A x B y ↔ xA + (aq) + yB - (aq) Ksp = [A +] x [B -] y. Untuk lebih mudah memahami materi kelarutan dan hasil kali kelarutan.

Makalah Kelarutan DAN Hasil KALI Kelaruatan Kelompok 5 Kapsel
ü Larutan lewat jenuh : hasil kali konsentrasi > Ksp. AmBn ⇋ mAn+(aq) + nBm-(aq) Ksp = [An+]m [Bm-]n. 2. Hubungan antara kelarutan dan hasil kali kelarutan. Tetapan hasil kali kelarutan dapat ditentukan dari harga kelarutan. a. Ag2CO3 (s) ⇋ 2Ag+(aq) + 3OH-(aq) jika kelarutan Ag2CO3 adalah s M, konsentrasi ion Ag+ adalah 2s M dan.

(DOC) hasil kali kelarutan Sani Ramadhani Academia.edu
14-1 Tetapan Hasil Kali Kelarutan, Ksp. Gipsum, CaSO4.2H2O, adalah mineral kalsium penting yang dapat ditemukan di seluruh bumi. Gipsum sedikit larut dalam air, dan air tanah yang bersentuhan dengan gipsum seringkali mengandung kalsium sulfat terlarut. Air jenis ini tidak dapat digunakan untuk hal-hal tertentu, seperti sistem pendingin uap pada.

TM 12 Kelarutan Dan Hasil Kali Kelarutan PDF
Kelarutan dan hasil kali kelarutan merupakan materi pelajaran yang akan dibahas pada artikel dibawah ini. Adapun materi pelajaran mengenai kelarutan dan hasil kali kelarutan ini adalah masuk kedalam aspek materi kimia yang biasanya di bahas di kelas XI. Dan yang menjadi fokus pembahasan yakni sebagai berikut : 1. Pengertian/definisi kelarutan. 2.

Bab 9Kelarutan Dan Hasil Kali Kelarutan PDF
Makalah Kelarutan dan Hasil Kali Kelarutan PDF. Istilah kelarutan ( solubility) digunakan untuk menyatakan jumlah maksimum yang dapat larut dalam sejumlah tertentu zat pelarut. Kelarutan dilambangkan dengan hurut s. Satuan kelarutan umumnya dinyatakan dalam gram L -1 atau Mol L -1. Partikel-partikel zat terlarut, baik berupa molekul atau ion.

(PPT) LKPD Kelarutan dan Hasil Kali Kelarutan Nida Sylva Rahmani
Makalah KBAK II Kelarutan DAN Hasil KALI Kelarutan KEL. 3. Course. Hujan Asam (GISKA-2021) 55 Documents. Students shared 55 documents in this course. University Universitas Islam Negeri Sultan Syarif Kasim. Academic year: 2021/2022. Uploaded by: Anonymous Student.

Kelarutan dan Hasil kali Kelarutan (Part 1) YouTube
Makalah ini secara garis besar membahas mengenai Kelarutan dan hasil kali kelarutan kimia. Dalam penulisan makalah ini, penulis mengucapkan terima kasih kepada Ibu Susilawati Amdayani, S., M. sebagai dosen pengampu mata kuliah Kapita Selekta Kimia SMA yang senantiasa memberikan petunjuk, arahan, dan motivasi dalam penyusunan makalah ini.

Makalah Kelarutan Dan Hasil Kali Kelarutan
Contoh Soal Kelarutan dan Hasil Kali Kelarutan (KSP) dan Pembahasan Contoh Soal 1: Hitunglah kelarutan Cu(OH) 2 dalam satuan g/L, jika diketahui K sp Cu(OH) 2 = 2,2 × 10 −20. Pembahasan: Contoh Soal 2: Hitunglah kelarutan molar PbI 2 dalam larutan KI 0,1 M. (K sp PbI 2 = 7,1 × 10 −9) Pembahasan: Dalam larutan, KI akan terdisosiasi menjadi.

Kelarutan Dan Hasil Kali Kelarutan PDF
4. Materi Kelarutan dan Hasil Kali Kelarutan Kelarutan dan Hasil Kali Kelarutan adalah materi kimia yang dipelajari oleh siswa di kelas XI IPA SMA pada semester genap, meliputi: a. Kelarutan b. Tetapan Hasil Kali Kelarutan (Ksp) c. Hubungan kelarutan dengan Ksp d. Pengaruh ion senama e. Ksp dan Reaksi Pengendapan Ruang lingkup materi kelarutan.

Hasil kali Kelarutan (Ksp) dan pH YouTube
Hal ini menyebabkan kelarutan AgCl lebih kecil dari kelarutannya dalam air murni. Perhitungan Kelarutan. Ksp tetap (pada suhu tertentu), kelarutan bisa berubah, bergantung pada ion-ion yang hadir dalam larutan. • Contoh: Tentukan kelarutan AgCl(s) dalam larutan NaCl 0,1 M, jika hasil kali kelarutan AgCl(s) adalah 1,7 1 0 1 0.
Kelarutan Dan Hasil Kali Kelarutan Ksp Tetapan Hubungan Dan Contoh Riset
Kelarutan dan Hasil Kali Kelarutan, antara gaya kognitif dan nilai kinerja di laboratorium dengan prestasi belajar Kelarutan dan Hasil Kali Kelarutan. 5 2. Gaya kognitif berkaitan dengan cara seseorang menghadapi tugas kognitif terutama dalam pemecahan masalah. 3. Pokok materi yang digunakan dalam penelitian ini adalah Kelarutan dan Hasil

Kelarutan dan Hasil Kali Kelarutan (Ksp) Kimia Kelas 11 • Part 7
hasil kali kelarutan dan menghubungkan kelarutan (s) dengan hasil kali kelarutan (Ksp) pada kegiatan inti. Proses pembelajaran dibantu dengan menggunakan modul multipel representasi yang telah dibagi pada setiap dua orang siswa. Setelah guru menjelaskan, guru meminta siswa untuk mengerjakan soal latihan dari setiap sub.

Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Soal dan Pembahasan
Pembelajaran yang berjudul " Modul Pembelajaran Kelarutan dan Hasil Kali Kelarutan ". 22. yenipratiwinst05 menerbitkan Modul Pembelajaran Kimia Kelarutan dan Hasil Kali Kelarutan pada 2021-03-24. Bacalah versi online Modul Pembelajaran Kimia Kelarutan dan Hasil Kali Kelarutan tersebut. Download semua halaman 1-25.

Makalah KBAK II Kelarutan DAN Hasil KALI Kelarutan KEL. 3 Hujan Asam
Hasil kali kelarutan dalam keadaan sebenarnya merupakan nilai akhir yang dicapai oleh hasil kali ion-ion ketika kesetimbangan tercapai antara fase padat dari garam yang hanya sedikit larut dan larutan itu. Hasil kali konsentrasi dari ion-ion pembentuknya untuk setiap suhu tertentu adalah konstan, dengan konsentrasi ion dipangkatkan bilangan.